Thuốc Teravir-Af 25Mg Natco Điều Trị Viêm Gan Siêu Vi B (30 Viên)
|
Quy cách |
Hộp 30 Viên
|
|
Thành phần |
Tenofovir alafenamide
|
|
Xuất xứ thương hiệu |
Ấn Độ
|
|
Nhà sản xuất |
NATCO PHARMA LTD.
|
|
Số đăng ký |
VN3-254-19
|
|
Thuốc cần kê toa |
Có
|
|
Mô tả ngắn |
Teravir – Af 25 mg do Natco Pharma Limited sản xuất, có thành phần chính là tenofovir 25 mg. Thuốc được chỉ định trong điều trị viêm gan B mạn tính ở người lớn và thanh thiếu niên. Teravir – Af 25 mg được đóng gói trong hộp 1 chai 30 viên nén bao phim. |
|
Lưu ý |
Sản phẩm này chỉ bản khi có chỉ định của bác sĩ, mọi thông tin trên Website chỉ mang tính chất tham khảo. |
NHÀ THUỐC PHARMAGO CAM KẾT

Đổi trả trong 7 ngày
Từ ngày mua hàng

100% Thuốc
Chính hãng

Giao hàng
Toàn quốc
Thuốc Teravir-Af 25mg là gì ?
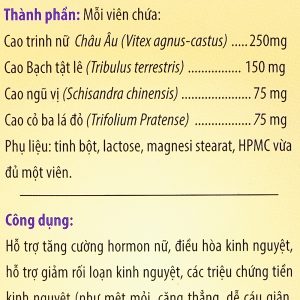
Thành phần của Thuốc Teravir-Af 25mg
|
Thông tin thành phần |
Hàm lượng |
|---|---|
|
Tenofovir alafenamide |
25 mg |
Công dụng của Thuốc Teravir-Af 25mg
Chỉ định
Thuốc Teravir – Af 25 mg được chỉ định dùng trong trường hợp điều trị viêm gan B mạn tính ở người lớn và thanh thiếu niên (từ 12 tuổi trở lên, nặng ít nhất 35 kg).
Dược lực học
Tenofovir alafenamide là tiền chất phosphonamidate của tenofovir (tương tự 2’ – deoxyadenosine monophosphate). Tenofovir alafenamide xâm nhập vào tế bào gan nguyên phát do sự khuếch tán thụ động và sự hấp thu ở gan bởi kênh vận chuyển OATP1B1 và OATP1B3.
Tenofovir alafenamide chủ yếu được thủy phân tạo thành tenofovir bằng carboxylesterase 1 ở tế bào gan nguyên phát. Tenofovir nội bào sau đó được phosphoryl hóa thành chất chuyển hóa có hoạt tính dược lý tenofovir diphosphate. Tenofovir diphosphate ức chế sự nhân lên của HBV thông qua việc kết hợp vào DNA virus bằng cách sao chép ngược HBV, dẫn đến kết thúc chuỗi DNA.
Tenofovir có hoạt tính cụ thể đối với viêm gan virus B và virus gây suy giảm miễn dịch ở người (HIV – 1 và HIV – 2). Tenofovir diphosphate là một chất ức chế của DNA polymerase động vật có vú bao gồm DNA polymerase γ ty thể và không có bằng chứng về độc tính đối với ty thể in vitro.
Dược động học
Hấp thu
Sau khi uống tenofovir lúc bụng đói ở bệnh nhân trưởng thành viêm gan B mạn tính, thuốc đạt nồng độ đỉnh sau khi uống 0,48 giờ. Trạng thái ổn định trung bình AUC0-24 của tenofovir alafenamide là 0,22 μg.giờ/ml và của tenofovir là 0,32 μg.giờ/ml. Trạng thái ổn định Cmax của tenofovir alafenamide và tenofovir lần lượt là 0,18 và 0,02 μg.giờ/ml. Khi uống thuốc chung với bữa ăn giàu chất béo, tiếp xúc tenofovir alafenamide tăng 65%.
Phân bố
Tenofovir alafenamide liên kết với protein huyết tương xấp xỉ 80%. Sự liên kết của tenofovir thấp hơn 0,7% và độc lập với nồng độ trong khoảng 0,01 – 25 μg/ml.
Chuyển hóa
Chuyển hóa là con đường thải trừ chính của tenofovir alafenamide trong cơ thể, chiếm trên 80% liều uống. In vitro, tenofovir alafenamide chuyển hóa chủ yếu thành tenofovir bởi carboxylesterase 1 trong tế bào gan và bởi cathepsin A trong PBMCs và đại thực bào. In vivo, tenofovir alafenamide bị thủy phân trong tế bào để tạo thành tenofovir rồi được phosphoryl hóa thành chất chuyển hóa có hoạt tính là tenofovir diphosphate.
In vitro, tenofovir alafenamide không bị chuyển hóa bởi CYP1A2, 2C8, 2C9, 2C19, 2D6. Tenofovir alafenamide bị chuyển hóa tối thiểu bởi CYP3A4.
Thải trừ
Dưới 1% tenofovir alafenamide còn nguyên vẹn bài tiết qua thận (nước tiểu). Tenofovir alafenamide và tenofovir có thời gian bán thải trung bình trong huyết tương lần lượt là 0,51 và 32,37 giờ. Tenofovir thải qua thận cả bằng lọc cầu thận và hoạt động bài tiết ở ống thận.
Cách dùng Thuốc Teravir-Af 25mg
Cách dùng
Nên uống thuốc trong cùng bữa ăn.
Liều dùng
Người lớn và thanh thiếu niên (từ 12 tuổi trở lên, nặng ít nhất 35 kg):
Uống 1 viên/ngày.
Suy thận:
Không cần chỉnh liều ở người lớn và thanh thiếu niên (từ 12 tuổi trở lên, nặng ít nhất 35 kg) có CrCl ≥ 15 ml/phút hoặc bệnh nhân chạy thận nhân tạo có CrCl < 15 ml/phút. Vào những ngày chạy thận nhân tạo, nên dùng tenofovir sau khi hoàn tất chạy thận.
Không khuyến cáo dùng ở bệnh nhân có CrCl < 15 ml/phút không chạy thận nhân tạo.
Suy gan:
Không cần chỉnh liều.
Trẻ em:
Không khuyến cáo dùng cho trẻ em dưới 12 tuổi hoặc nặng dưới 35 kg.
Ngưng điều trị có thể được xem xét khi:
-
Ở bệnh nhân dương tính với HBeAg không có xơ gan, nên điều trị ít nhất 6 – 12 tháng sau khi chuyển đổi kết quả huyết thanh HBe (mất HBeAg và HBV DNA với sự phát hiện kháng HBe) được xác nhận hoặc cho đến khi sự chuyển đổi huyết thanh HBs hoặc cho đến khi mất hiệu quả. Cần đánh giá thường xuyên sau khi ngừng điều trị để phát hiện sự tái phát virus.
-
Ở bệnh nhân âm tính với HBeAg không có xơ gan, nên điều trị ít nhất đến khi sự chuyển đổi kết quả huyết thanh hoặc đến khi có dấu hiệu mất hiệu quả. Với điều trị kéo dài hơn 2 năm, cần đánh giá lại thường xuyên để xác nhận rằng tiếp tục lựa chọn liệu pháp vẫn còn thích hợp cho bệnh nhân.
Lưu ý: Liều dùng trên chỉ mang tính chất tham khảo. Liều dùng cụ thể tùy thuộc vào thể trạng và mức độ diễn tiến của bệnh. Để có liều dùng phù hợp, bạn cần tham khảo ý kiến bác sĩ hoặc chuyên viên y tế.
Làm gì khi dùng quá liều?
Theo dõi các bằng chứng về độc tính khi quá liều xảy ra.
Cách xử trí: Các biện pháp bổ trợ chung bao gồm theo dõi dấu hiệu sống còn, quan sát tình trạng lâm sàng của bệnh nhân.
Tenofovir được loại bỏ bằng chạy thận nhân tạo với hệ số chiết xuất xấp xỉ 54%. Chưa biết thuốc có thể được loại bỏ bằng thẩm phân phúc mạc không.
Làm gì khi quên 1 liều?
Nếu quên liều và ít hơn 18 giờ kể từ khi dùng thuốc, bệnh nhân nên dùng thuốc sớm nhất có thể và sau đó tiếp tục tiếp tục lại dùng liều như bình thường. Nếu quá 18 giờ kể từ khi dùng thuốc, bệnh nhân bỏ qua liều đã quên và dùng liều tiếp theo như lịch trình bình thường.
Tác dụng phụ
Khi sử dụng thuốc Teravir – Af 25 mg, bạn có thể gặp các tác dụng không mong muốn (ADR).
Rất thường gặp, ADR > 1/10
-
Thần kinh: Đau đầu.
Thường gặp, ADR > 1/100
-
Tiêu hóa: Tiêu chảy, buồn nôn, nôn, đau bụng, chướng bụng, đầy hơi.
-
Toàn thân: Mệt mỏi.
-
Thần kinh: Chóng mặt.
-
Gan mật: Tăng ALT.
-
Cơ xương khớp: Đau khớp.
Ít gặp, 1/1000 < ADR < 1/100
-
Da: Phù mạch, mề đay.
Hướng dẫn cách xử trí ADR
Khi gặp tác dụng phụ của thuốc, cần ngưng sử dụng và thông báo cho bác sĩ hoặc đến cơ sở y tế gần nhất để được xử trí kịp thời.
Lưu ý
Trước khi sử dụng thuốc bạn cần đọc kỹ hướng dẫn sử dụng và tham khảo thông tin bên dưới.
Chống chỉ định
Thuốc Teravir – Af 25 mg chống chỉ định trong trường hợp quá mẫn với bất kỳ thành phần nào của thuốc.
Thận trọng khi sử dụng
Tenofovir không ngăn ngừa được nguy cơ lây truyền HBV sang người khác thông qua quan hệ tình dục hoặc đường máu. Phải tiếp tục sử dụng các biện pháp phòng ngừa thích hợp.
Không có dữ liệu an toàn và hiệu quả khi dùng thuốc ở bệnh nhân nhiễm HBV có bệnh gan mất bù và điểm Child Pugh Turcotte > 9 (cấp C). Những bệnh nhân này có nguy cơ cao bị tác dụng phụ lên gan, thận nên cần theo dõi chặt chẽ.
Khi điều trị bằng thuốc kháng virus, có thể tăng ALT huyết thanh ở một vài bệnh nhân. Ở bệnh nhân có bệnh gan còn bù, sự tăng ALT huyết thanh không đi kèm với tăng nồng độ bilirubin huyết thanh hoặc sự mất bù gan. Bệnh nhân xơ gan có nguy cơ mất bù gan cao hơn khi viêm gan trầm trọng hơn, cần theo dõi chặt chẽ đối tượng này.
Đợt kịch phát cấp của viêm gan đã được báo cáo ở bệnh nhân đã ngừng điều trị viêm gan B, thường do tăng nồng độ HBV DNA huyết tương. Cần theo dõi chức năng gan định kỳ với nghiên cứu lâm sàng và xét nghiệm trong ít nhất 6 tháng sau khi ngừng thuốc. Nếu cần thiết, phải tiếp tục điều trị viêm gan B.
Ở bệnh nhân bệnh gan tiến triển hoặc xơ gan không khuyến cáo ngưng điều trị vì sau đợt điều trị kịch phát của viêm gan có thể dẫn đến mất bù gan, sự bùng phát bệnh gan đặc biệt nghiêm trọng và đôi khi gây tử vong.
Không thể loại trừ nguy cơ nhiễm độc thận do phơi nhiễm mạn tính ở mức thấp tenofovir.
Nên kiểm tra kháng thể HIV ở bệnh nhân đồng nhiễm HBV và HIV – 1 đồng thời phối hợp với các thuốc kháng retrovirus kháng theo phác đồ trị HIV.
Không dùng chung TERAVIR – AF với các thuốc có chứa tenofovir alafenamide, tenofovir disoproxil fumarate, adenovir dipivoxil.
Khả năng lái xe và vận hành máy móc
Thuốc không ảnh hưởng hoặc ảnh hưởng không đáng kể lên khả năng lái xe và vận hành máy móc. Bệnh nhân cần thận trọng nếu bị chóng mặt khi dùng thuốc.
Thời kỳ mang thai
Dữ liệu hạn chế về việc dùng thuốc cho phụ nữ có thai. Tuy nhiên, lượng lớn dữ liệu trên phụ nữ có thai cho thấy không có biểu hiện dị dạng và độc tính trên trẻ sơ sinh khi dùng thuốc. In vivo, không thấy tác động trực tiếp và gián tiếp tới sinh sản.
Có thể xem xét sử dụng tenofovir khi mang thai nếu cần thiết.
Thời kỳ cho con bú
Chưa biết liệu tenofovir có bài tiết vào sữa mẹ không. In vivo, thuốc qua được sữa mẹ. Không có đầy đủ thông tin về ảnh hưởng của thuốc lên trẻ sơ sinh. Không thể loại trừ nguy cơ trên trẻ bú mẹ, do đó không dùng thuốc khi đang cho con bú.
Tương tác thuốc
Tenofovir alafenamide là chất nền của P – glycoprotein (P – gp) và BCRP. Những thuốc cảm ứng hoạt động của P – gp làm giảm hấp thu và làm giảm nồng độ tenofovir trong máu. Các thuốc ức chế hoạt động P – gp và BCRP làm tăng nồng độ tenofovir trong máu.
Không khuyến cáo sử dụng đồng thời tenofovir với thuốc chống động kinh (carbamazepine, oxcarbazepine, phenobarbital, phenytoin), thuốc kháng lao (rifampicin, rifapentine, rifabutin), St. John’s wort do khả năng làm giảm nồng độ tenofovir trong máu, giảm hiệu quả điều trị.
Không khuyến cáo sử dụng đồng thời tenofovir với chất ức chế mạnh P – gp như thuốc kháng nấm (itraconazole, ketoconazole) do khả năng làm tăng nồng độ tenofovir trong máu, tăng độc tính.
Tenofovir bài tiết chủ yếu qua thận (qua lọc cầu thận và bài tiết tích cực ở ống thận). Dùng phối hợp với các thuốc làm giảm hoạt động của thận hoặc cạnh tranh bài tiết tích cực ở ống thận (acyclovir, cidofovir, ganciclovir, valacyclovir, valganciclovir, aminoglycoside, liều cao NSAIDs…) có thể làm tăng nồng độ tenofovir trong máu, dẫn đến tăng độc tính.
Bảo quản
Bảo quản trong bao bì gốc, không quá 30°C.
































































Reviews
There are no reviews yet.